АМИНОКИСЛОТЫ
аминокарбоновые кислоты, - органич. соединения, содержащие карбоксильную группу (- СООН) и аминогруппу (- NH 2) и обладающие одновременно св-вами к-т и оснований. По взаимному расположению функци-он. групп различают альфа-, бета-, y-, сигма- и w-аминокислоты; напр., RCH(NH 2)COOH - а-А., RCH(NH 2)CH 2 COOH - бета-А. Широко распространены в природе. Ок. 20 альфа-А. (аргинин, валин, лейцин, лизин, метионин, цистеин и др.) входят в состав молекул всех белков (последовательность звеньев альфа-А. определяется генетич. кодом). Синтетич. А. используют для обогащения кормов, получения полиамидов, красителей, лекарств, средств.
Большой энциклопедический политехнический словарь . 2004 .
Смотреть что такое "АМИНОКИСЛОТЫ" в других словарях:
Органические (карбоновые) кислоты, содержащие, как правило, одну или две аминогруппы (NH2). В зависимости от положения аминогруппы в углеродной цепи по отношению к карбоксилу различают а, b , y и т. д. А. в природе широко распространены a А.,… … Биологический энциклопедический словарь
АМИНОКИСЛОТЫ, класс органических соединений, содержащих карбоксильные (COOH) и аминогруппы (NH2); обладают свойствами и кислот, и оснований. Участвуют в обмене азотистых веществ всех организмов (исходные соединения при биосинтезе гормонов,… … Современная энциклопедия
Класс органических соединений, содержащих карбоксильные (COOH) и аминогруппы (NH2); обладают свойствами и кислот, и оснований. Участвуют в обмене азотистых веществ всех организмов (исходное соединение при биосинтезе гормонов, витаминов,… … Большой Энциклопедический словарь
АМИНОКИСЛОТЫ, от, ед. аминокислота, ы, жен. (спец.). Класс органических соединений, обладающих свойствами и кислот, и оснований. | прил. аминокислотный, ая, ое. Толковый словарь Ожегова. С.И. Ожегов, Н.Ю. Шведова. 1949 1992 … Толковый словарь Ожегова
Орг. соединения с двойной функцией кислотной, обусловленной присутствием карбоксильной группы (см. Карбоксил), и основной, связанной с наличием аминогруппы (NH2) или (реже) иминогруппы (NH), входящей обычно в состав гетероцикла. Примеры … Геологическая энциклопедия
аминокислоты - органические соединения, содержащие одну или две аминогруппы; производные карбоновых кислот, у которых в радикале водород замещен на аминогруппу; структурные единицы белковой молекулы. белковые: аланин. аргинин. аспарагин. пролин. аспарагиновая… … Идеографический словарь русского языка
аминокислоты - – карбоновые кислоты, у которых, как минимум, один атом углерода углеводородной цепи замещен на аминогруппу … Краткий словарь биохимических терминов
АМИНОКИСЛОТЫ - АМИНОКИСЛОТЫ, органические кислоты (содержащие группу СООН), в к рых один или несколько атомов Н в алкогольном радикале замещены щелочными амино группа ми (NHa), вследствие чего А. принадлежат к г. н. амфотерным соединениям. В зависимо сти от… … Большая медицинская энциклопедия - В этой статье не хватает ссылок на источники информации. Информация должна быть проверяема, иначе она может быть поставлена под сомнение и удалена. Вы можете … Википедия
Отправить свою хорошую работу в базу знаний просто. Используйте форму, расположенную ниже
Студенты, аспиранты, молодые ученые, использующие базу знаний в своей учебе и работе, будут вам очень благодарны.
Размещено на http://www.allbest.ru/
1. Нитросоединения
Нитросоединениями называются органические вещества, в молекулах которых содержится нитрогруппа -NO 2 при атоме углерода
Их можно рассматривать как производные углеводородов, получающиеся путем замещения атома водорода на нитрогруппу. По числу нитрогрупп различают моно-, ди- и полинитросоединения.
Названия нитросоединемий производят от названий исходных углеводородов с добавлением приставки нитро -:
Общая формула этих соединений R-NO 2 .
Введение в органическое вещество нитрогруппы называется нитрованием. Его можно проводить разными способами. Нитрование ароматических соединений легко осуществимо при действии смесью концентрированных азотной и серной кислот (первая - нитрующий агент, вторая - водоотнимающий):
Тринитротолуол хорошо известен как взрывчатое вещество. Взрывается только от детонации. Горит коптящим пламенем без взрыва.
Нитрование предельных углеводородов проводится при действии на углеводороды разбавленной азотной кислотой при нагревании и повышенном давлении (реакция М.И. Коновалова ):
Нитросоединения часто также получают взаимодействием алкил-галогенидов с нитритом серебра:
При восстановлении нитросоединений образуются амины.
2. Азотсодержащие гетероциклические соединения
Гетероциклические соединения -это органические соединения, содержащие в своих молекулах кольца (циклы), в образовании которых кроме атома углерода принимают у частие и атомы других элементов
Атомы других элементов, входящие в состав гетероцикла, называются гетероатомами. Наиболее часто встречаются в составе гетероциклов гетероатомы азота, кислорода, серы, хотя могут существовать гетероциклические соединения с самыми различными элементами, имеющими валентность не менее двух.
Гетероциклические соединения могут иметь в цикле 3, 4, 5, 6 и более атомов. Однако наибольшее значение имеют пяти- и шестичленные гетероциклы. Эти циклы, как и в ряду карбоциклических соединений, образуются наиболее легко и отличаются наибольшей прочностью. В гетероцикле может содержаться один, два и более гетероатомов.
Во многих гетероциклических соединениях электронное строение связей в кольце такое же, как и в ароматических соединениях. Поэтому типичные гетероциклические соединения условно обозначают не только формулами, содержащими чередующиеся двойные и одинарные связи, но и формулами, в которых сопряжение? - электронов обозначается кружком, вписанным в формулу.
Для гетероциклов обычно пользуются эмпирическими названиями.
Шестичленные гетероциклы
Большое значение имеют гетероциклы, конденсированные с бензольным кольцом или с другим гетероциклом, например пурин:
Шестичленные гетероциклы. Пиридин C 5 H 5 N - простейший шестичленный ароматический гетероцикл с одним атомом азота. Его можно рассматривать как аналог бензола, в котором одна группа СН заменена на атом азота:
Пиридин представляет собой бесцветную жидкость, немного легче воды, с характерным неприятным запахом; с водой смешивается в любых отношениях. Пиридин и его гомологи выделяют из каменноугольной смолы. В лабораторных условиях пиридин можно синтезировать из синильной кислоты и ацетилена:
Химические свойства пиридина определяются наличием ароматической системы, содержащей шесть? - электронов, и атома азота с неподеленной электронной парой.
При взаимодействии пиридина с сильными кислотами образуются соли пиридиния:
2. Ароматические свойства. Подобно бензолу, пиридин вступает в реакции электрофильного замещения, однако, его активность в этих реакциях ниже, чем бензола, из-за большой электроотрицательности атома азота. Пиридин нитруется при 300° С с низким выходом:
Атом азота в реакциях электрофильного замещения ведет себя как заместитель 2-го рода, поэтому электрофильное замещение происходит вмета-положение.
В отличие от бензола пиридин способен вступать в реакции нуклеофильного замещения, поскольку атом азота оттягивает на себя электронную плотность из ароматической системы и орто-пара-положения по отношению к атому азота обеднены электронами. Так, пиридин может реагировать с амидом натрия, образуя смесь орто- и пара-аминопиридинов (реакция Чичибабина):
При гидрировании пиридина ароматическая система разрушается и образуется пиперидин, который представляет собой циклический вторичный амин и является гораздо более сильным основанием, чем пиридин:
Пиримидин C 4 H 4 N 2 - шестичленный гетероцикл с двумя атомами азота. Его можно рассматривать как аналог бензола, в котором две группы СН заменены на атомы азота:
Благодаря наличию в кольце двух электроотрицательных атомов азота пиримидин еще менее активен в реакциях электрофильного замещения, чем пиридин. Его основные свойства также выражены слабее, чем у пиридина.
Основное значение пиримидина состоит в том, чтоонявляется родоначальником класса пиримидиновых оснований.
Пиримидиновые основания -производные пиримидина, остатки которых входят в состав нуклеиновых кислот: урацил, тимин, цитозин.
Каждое из этих оснований может существовать в двух формах. В свободном состоянии основания существуют в ароматической форме, а в состав нуклеиновых кислот они входят в NH-форме.
Соединения с пятичленным циклом. Пиррол C 4 H 4 NH - пятичленныи гетероцикл с одним атомом азота.
Ароматическая система содержит шесть? - электронов (по одному от четырех атомов углерода и пара электронов атома азота). В отличие от пиридина электронная пара атома азота в пирроле входит в состав ароматической системы, поэтому пиррол практически лишен основных свойств.
Пиррол - бесцветная жидкость с запахом, напоминающим запах хлороформа. Пиррол слабо растворим в воде (< 6%), но растворим в органических растворителях. На воздухе быстро окисляется и темнеет.
Пиррол получают конденсацией ацетилена с аммиаком:
или аммонолизом пятичленных циклов с другими гетероатомами (реакция Юрьева):
Пиррол проявляет свойства очень слабой кислоты. Онреагирует с калием, образуя пиррол-калий:
Пиррол, как ароматическое соединение, склонен к реакциям электрофильного замещения, которые протекают преимущественно у? - атома углерода (соседнего с атомом азота).
При гидрировании пиррола образуется пирролидин - циклический вторичный амин, проявляющий основные свойства:
3. Амины
Амины -органические соединения, которые можно рассматривать как производные аммиака, в котором атомы водорода (один или несколько) заме щены на углеводородные радикалы
В зависимости от природы радикала амины могут быть алифатическими (предельными и непредельными), алициклическими, ароматическими, гетероциклическими. Они подразделяются на первичные, вторичные, третичные в зависимости от того, сколько атомов водорода замещено на радикал.
Четвертичные аммониевые соли типа + Cl? - это органические аналоги неорганических аммониевых солей.
Названия первичных аминов обычно производят от названий соответствующих углеводородов, добавляя к ним приставку амино- или окончание - а мин . Названия вторичных и третичных аминов чаще всего образуют по принципам рациональной номенклатуры, перечисляя имеющиеся в соединении радикалы:
первичные R-NH 2:СН 3 -NH 2 - метиламин; С 6 Н 5 -NH 2 - фениламин;
вторичные R-NH-R": (CH 2) NH - диметиламин; С 6 Н 5 -NH-СН 3 - метилфениламин;
третичные R-N(R") - R»: (СН 3) 3 Н - триметиламин; (C 6 H 5) 3 N - трифениламин.
Получение. 1. Нагревание алкилгалогенидов с аммиаком под давлением приводит к последовательному алкилированию аммиака, при этом образуется смесь солей первичных, вторичных и третичных аминов, которые дегидрогалогенируются при действии оснований:
2. Ароматические амины получают восстановлением нитросоединений:
Для восстановления можно использовать цинк или железо в кислой среде или алюминий в щелочной среде.
Физические свойства. Простейшие алифатические амины при нормальных условиях представляют собой газы или жидкости с низкой температурой кипения, обладающие резким запахом. Все амины являются полярными соединениями, что приводит к образованию водородных связей в жидких аминах, и следовательно, температурыих кипения превышают температуры кипения соответствующих алканов. Первые представители ряда аминов растворяются в воде, по мере роста углеродного скелета их растворимость в воде уменьшается. Амины растворимы также в органических растворителях.
Химические свойства. 1. Основные свойства. Будучи производными аммиака, все амины обладают основными свойствами, причем алифатические амины являются более сильными основаниями, чем аммиак, а ароматические - более слабыми. Это объясняется тем, что радикалы СН 3 -, С 2 Н 5 - и др. проявляют положительный индуктивный (+I) эффект и увеличивают электронную плотность на атоме азота:
что приводит к усилению основных свойств. Напротив, фенильный радикал C 6 H 5 - проявляет отрицательный мезомерный (-М) эффект и уменьшает электронную плотность на атоме азота:
Щелочная реакция растворов аминов объясняется образованием гидроксильных ионов при взаимодействии аминов с водой:
Амины в чистом виде или в растворах взаимодействуют с кислотами, образуя соли:
Обычно соли аминов - твердые вещества без запаха, хорошо растворимые в воде. В то время как амины хорошо растворимы в органических растворителях, соли аминов в них не растворяются.
3. Реакции с азотистой кислотой. а) Первичные алифатические амины при действии азотистой кислоты превращаются в спирты:
Важнейшие представители аминов. Простейшие алифатические амины - метиламин, диметиламин, диэтиламин - находят применение при синтезе лекарственных веществ и других продуктов органического синтеза. Гексаметилендиамин NH 2 - (СН 2) 2 -NH 6 является одним из исходных веществ для получения важного полимерного материала нейлона.
Анилин C 6 H 5 NH 2 - важнейший из ароматических аминов. Он представляет собой бесцветную маслянистую жидкость, мало растворимую в воде. Для качественного обнаружения анилина используют его реакцию с бромной водой, в результате которой выпадает белый осадок 2,4,6 - триброманилина:
Анилин применяется для получения красителей, лекарственных препаратов, пластмасс и т.д.
4. Аминокислоты
Аминокислоты -это органические бифункциональные соединения, в состав которых входят карбоксильная группа - С ООН и аминогруппа - N H 2 . В зависимости от взаимного расположения обеих функциональных групп различают a---,--b---,--g - аминокислоты и т.д.:
Греческая буква при атоме углерода обозначает его удаленность от карбоксильной группы. Обычно рассматривают только? - аминокислоты, поскольку другие аминокислоты в природе не встречаются.
В состав белков входят 20 основных аминокислот (см. табл.).
Получение. 1. Гидролиз белковых веществ обычно дает сложные смеси аминокислот. Однако разработан ряд методов, позволяющих из сложных смесей получать отдельные чистые аминокислоты.
2. Замещение галогена на аминогруппу в соответствующих галогенокислотах. Этот способ получения аминокислот полностью аналогичен получению аминов из гало-генопроизводных алканов и аммиака:
Физические свойства. Аминокислоты представляют собой твердые кристаллические вещества, хорошо растворимые в воде и мало растворимые в органических растворителях. Многие аминокислоты имеют сладкий вкус. Они плавятся при высоких температурах и обычно при этом разлагаются. В парообразное состояние переходить не могут.
Химические свойства. Аминокислоты - это органические амфотерные соединения. Они содержат в составе молекулы две функциональные группы противоположного характера: аминогруппу с основными свойствами и карбоксильную группу с кислотными свойствами. Аминокислоты реагируют как с кислотами, так и с основаниями:
Кислотно-основные превращения аминокислот в различных средах можно изобразить следующей схемой:
Водные растворы аминокислот имеют нейтральную, щелочную или кислую среду в зависимости от количества функциональных групп. Так, глутаминовая кислота образует кислый раствор (две группы - СООН, одна - NH 2), лизин - щелочной (одна группа - СООН, две - NH 2).Важнейшее свойство аминокислот - их способность к конденсации с образованием пептидов.
Пептиды. Пептиды. -это продукты конденсации двух или более молекул аминокислот. Две молекулы аминокислоты могут реагировать друг с другом с отщеплением молекулы воды и образованием продукта, в котором фрагменты связаны пептидной связью - СО-NH -.
нитросоединение химический аминокислота углерод
Основное свойство пептидов - способность к гидролизу. При гидролизе происходит полное или частичное расщепление пептидной цепи и образуются более короткие пептиды с меньшей молекулярной массой или а-аминокислоты, составляющие цепь. Анализ продуктов полного гидролиза позволяет установить аминокислотный состав пептида. Полный гидролиз происходит при длительном нагревании пептида с концентрированной соляной кислотой.
Ферментативный гидролиз важен тем, что протекает селективно, т.е. позволяет расщеплять строго определенные участки пептидной цепи.
Качественные реакции на аминокислоты. 1) Все аминокислоты окисляются нингидрином с образованием продуктов, окрашенных в сине-фиолетовый цвет. Эта реакция может быть использована для количественного определения аминокислот спектрофотометрическим методом. 2 ) При нагревании ароматических аминокислот с концентрированной азотной кислотой происходит нитрование бензольного кольца и образуются соединения, окрашенные в желтый цвет. Эта реакция называется ксантопротеиновой (от греч. ксантос - желтый).
Размещено на Allbest.ru
...Подобные документы
Нитросоединения - органические соединения, в молекуле которых содержится группа NO2, их строение и получение методом нитрования алканов (замещение водорода) и нуклеофильным замещением галогена. Cвойства алифатических нитросоединений и нитроаренов.
контрольная работа , добавлен 05.08.2013
Белки – высокомолекулярные азотсодержащие органические вещества, молекулы которых построены из остатков аминокислот. Наследственная информация сосредоточена в молекуле ДНК. С помощью белков реализуется генетическая информация. Классификация аминокислот.
реферат , добавлен 17.01.2009
Органические соединения І группы. Натрииорганические соединения - органические соединения, содержащие связь C-Na. Органические производные кальция, стронция, бария и магния. Борорганические соединения. Соединения алюминия. Кремнийорганические соединения.
реферат , добавлен 10.04.2008
Свойства, применение, синтезы акридона. Реакции замыкания цикла. Типы реакций. Замещение при насыщенном атоме углерода. Внутримолекулярное нуклеофильное присоединение к карбонильной группе и к другим двойным связям. Электролитические реакции. Акридин.
курсовая работа , добавлен 09.11.2008
Аминокислоты – азотсодержащие органические соединения. Способы их получения. Физические и химические свойства. Изомерия и номенклатура. Аминокислоты необходимы для синтеза белков в живых организмах. Применение в медицине и для синтеза некоторых волокон.
презентация , добавлен 21.04.2011
Гликозиды - органические соединения, история их изучения и свойства. Ботаническая, фармакологическая и химическая классификация. Образование гликозидов в растениях, их роль и методы выделения. Качественные реакции и количественное определение гликозидов.
презентация , добавлен 02.12.2015
Аминокислоты (аминокарбоновые кислоты) - органические соединения, в молекуле которых содержатся карбоксильные, а также аминные группы. Открытие аминокислот в составе белков. Оптическая изомерия. D-аминокислоты в живых организмах. Карбоксильная группа.
презентация , добавлен 23.05.2012
Химические соединения с высокой молекулярной массой (от нескольких тысяч до многих миллионов). Свойства и важнейшие характеристики, получение, применение. Поверхностно-активные вещества: молекулярное строение и получение, свойства и применение.
реферат , добавлен 05.02.2008
Физико-химические свойства аминокислот. Получение аминокислот в ходе гидролиза белков или как результат химических реакций. Ряд веществ, способных выполнять некоторые биологические функции аминокислот. Способность аминокислоты к поликонденсации.
презентация , добавлен 22.05.2012
Понятие, строение молекул, химические свойства галогеналканов. Особенности реакций замещения и присоединения как способов получения галогеналканов, условия протекания этих процессов. Реакции нуклеофильного замещения при насыщенном атоме углерода.
Предельные одноатомные и многоатомные спирты
Спиртами (или алканолами) называются органические вещества, молекулы которых содержат одну или несколько гидроксильных групп (групп $—ОН$), соединенных с углеводородным радикалом.
По числу гидроксильных групп (атомности) спирты делятся на:
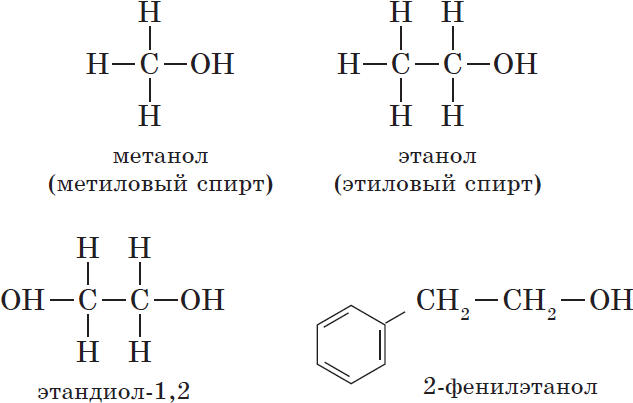
— одноатомные, например:
${CH_3-OH}↙{метанол(метиловый спирт)}$ ${CH_3-CH_2-OH}↙{этанол(этиловый спирт)}$
— двухатомные (гликоли) , например:
${OH-CH_2-CH_2-OH}↙{этандиол-1,2(этиленгликоль)}$
${HO-CH_2-CH_2-CH_2-OH}↙{пропандиол-1,3}$
— трехатомные , например:
По характеру углеводородного радикала выделяют следующие спирты:
— предельные , содержащие в молекуле лишь предельные углеводородные радикалы, например:
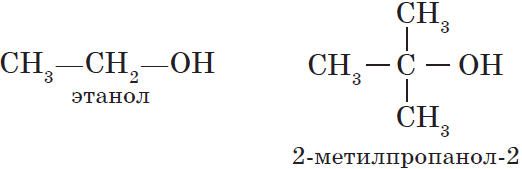
— непредельные , содержащие в молекуле кратные (двойные и тройные) связи между атомами углерода, например:
${CH_2=CH-CH_2-OH}↙{пропен-2-ол-1 (аллиловый спирт)}$
— ароматические , т.е. спирты, содержащие в молекуле бензольное кольцо и гидроксильную группу, связанные друг с другом не непосредственно, а через атомы углерода, например:
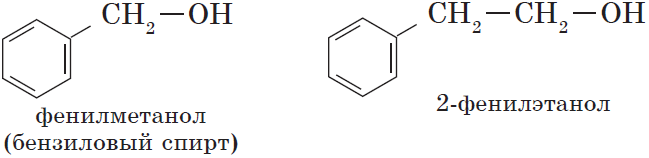
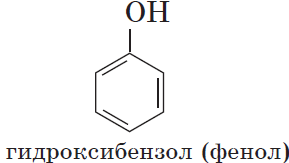
Органические вещества, содержащие в молекуле гидроксильные группы, связанные непосредственно с атомом углерода бензольного кольца, существенно отличаются по химическим свойствам от спиртов и поэтому выделяются в самостоятельный класс органических соединений — фенолы. Например:
Существуют и полиатомные (многоатомные) спирты, содержащие более трех гидроксильных групп в молекуле. Например, простейший шестиатомный спирт гексаол (сорбит):
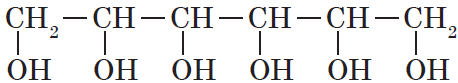
Номенклатура и изомерия
При образовании названий спиртов к названию углеводорода, соответствующего спирту, добавляют родовой суффикс -ол. Цифрами после суффикса указывают положение гидроксильной группы в главной цепи, а префиксами ди-, три-, тетра- и т. д. — их число:
В нумерации атомов углерода в главной цепи положение гидроксильной группы приоритетно перед положением кратных связей:
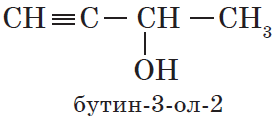
Начиная с третьего члена гомологического ряда, у спиртов появляется изомерия положения функциональной группы (пропанол-1 и пропанол-2), а с четвертого — изомерия углеродного скелета (бутанол-1, 2-метилпропанол-1). Для них характерна и межклассовая изомерия — спирты изомерны простым эфирам:
${CH_3-CH_2-OH}↙{этанол}$ ${CH_3-O-CH_3}↙{диметиловый эфир}$
спиртов
Физические свойства.
Спирты могут образовывать водородные связи как между молекулами спирта, так и между молекулами спирта и воды.
Водородные связи возникают при взаимодействии частично положительно заряженного атома водорода одной молекулы спирта и частично отрицательно заряженного атома кислорода другой молекулы. Именно благодаря водородным связям между молекулами спирты имеют аномально высокие для своей молекулярной массы температуры кипения. Так, пропан с относительной молекулярной массой $44$ при обычных условиях является газом, а простейший из спиртов — метанол, имея относительную молекулярную массу $32$, в обычных условиях — жидкость.
Низшие и средние члены ряда предельных одноатомных спиртов, содержащие от $1$ до $11$ атомов углерода, — жидкости. Высшие спирты (начиная с $С_{12}Н_{25}ОН$) при комнатной температуре — твердые вещества. Низшие спирты имеют характерный алкогольный запах и жгучий вкус, они хорошо растворимы в воде. По мере увеличения углеводородного радикала растворимость спиртов в воде понижается, а октанол уже не смешивается с водой.
Химические свойства.
Свойства органических веществ определяются их составом и строением. Спирты подтверждают общее правило. Их молекулы включают в себя углеводородные и гидроксильные радикалы, поэтому химические свойства спиртов определяются взаимодействием и влиянием друг на друга этих групп. Характерные для данного класса соединений свойства обусловлены наличием гидроксильной группы.
1. Взаимодействие спиртов со щелочными и щелочноземельными металлами. Для выявления влияния углеводородного радикала на гидроксильную группу необходимо сравнить свойства вещества, содержащего гидроксильную группу и углеводородный радикал, с одной стороны, и вещества, содержащего гидроксильную группу и не содержащего углеводородный радикал, — с другой. Такими веществами могут быть, например, этанол (или другой спирт) и вода. Водород гидроксильной группы молекул спиртов и молекул воды способен восстанавливаться щелочными и щелочноземельными металлами (замещаться на них):
$2Na+2H_2O=2NaOH+H_2$,
$2Na+2C_2H_5OH=2C_2H_5ONa+H_2$,
$2Na+2ROH=2RONa+H_2$.
2. Взаимодействие спиртов с галогеноводородами. Замещение гидроксильной группы на галоген приводит к образованию галогеналканов. Например:
$C_2H_5OH+HBr⇄C_2H_5Br+H_2O$.
Данная реакция обратима.
3. Межмолекулярная дегидратация спиртов — отщепление молекулы воды от двух молекул спирта при нагревании в присутствии водоотнимающих средств:
В результате межмолекулярной дегидратации спиртов образуются простые эфиры. Так, при нагревании этилового спирта с серной кислотой до температуры от $100$ до $140°С$ образуется диэтиловый (серный) эфир:
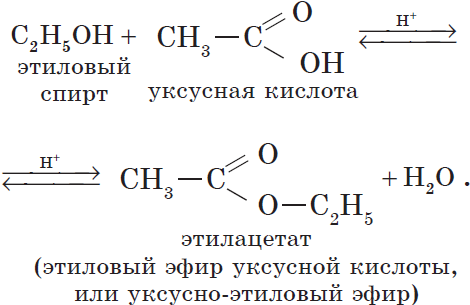
4. Взаимодействие спиртов с органическими и неорганическими кислотами с образованием сложных эфиров (реакция этерификации ):
Реакция этерификации катализируется сильными неорганическими кислотами.
Например, при взаимодействии этилового спирта и уксусной кислоты образуется уксусноэтиловый эфир — этилацетат :
5. Внутримолекулярная дегидратация спиртов происходит при нагревании спиртов в присутствии водоотнимающих средств до более высокой температуры, чем температура межмолекулярной дегидратации. В результате образуются алкены. Эта реакция обусловлена наличием атома водорода и гидроксильной группы при соседних атомах углерода. В качестве примера можно привести реакцию получения этена (этилена) при нагревании этанола выше $140°С$ в присутствии концентрированной серной кислоты:
6. Окисление спиртов обычно проводят сильными окислителями, например, дихроматом калия или перманганатом калия в кислой среде. При этом действие окислителя направляется на тот атом углерода, который уже связан с гидроксильной группой. В зависимости от природы спирта и условий проведения реакции могут образовываться различные продукты. Так, первичные спирты окисляются сначала в альдегиды , а затем в карбоновые кислоты:
При окислении вторичных спиртов образуются кетоны:
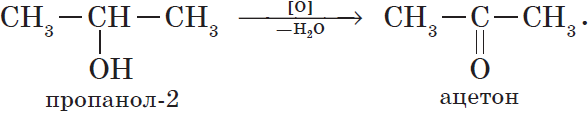
Третичные спирты достаточно устойчивы к окислению. Однако в жестких условиях (сильный окислитель, высокая температура) возможно окисление третичных спиртов, которое происходит с разрывом углерод-углеродных связей, ближайших к гидроксильной группе.
7. Дегидрирование спиртов. При пропускании паров спирта при $200-300°С$ над металлическим катализатором, например медью, серебром или платиной, первичные спирты превращаются в альдегиды, а вторичные — в кетоны:
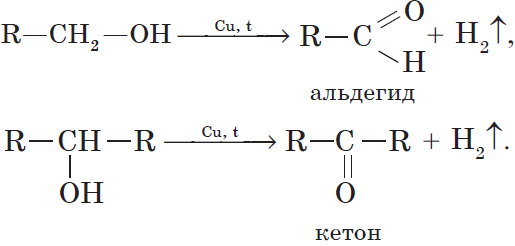
Присутствием в молекуле спирта одновременно нескольких гидроксильных групп обусловлены специфические свойства многоатомных спиртов , которые способны образовывать растворимые в воде ярко-синие комплексные соединения при взаимодействии со свежеполученным осадком гидроксида меди (II). Для этиленгликоля можно записать:
Одноатомные спирты не способны вступать в эту реакцию. Поэтому она является качественной реакцией на многоатомные спирты.
Фенол
Строение фенолов
Гидроксильная группа в молекулах органических соединений может быть связана с ароматическим ядром непосредственно, а может быть отделена от него одним или несколькими атомами углерода. Можно ожидать, что в зависимости от этого свойства, вещества будут существенно отличаться друг от друга из-за взаимного влияния групп атомов. И действительно, органические соединения, содержащие ароматический радикал фенил $С_6Н_5$—, непосредственно связанный с гидроксильной группой, проявляют особые свойства, отличные от свойств спиртов. Такие соединения называются фенолами.
Фенолы — органические вещества, молекулы которых содержат радикал фенил, связанный с одной или несколькими гидроксогруппами.
Так же как и спирты, фенолы классифицируют по атомности, т.е. по количеству гидроксильных групп.
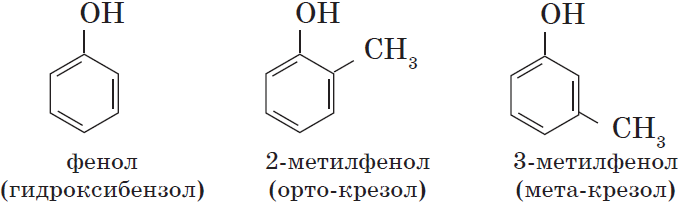
Одноатомные фенолы содержат в молекуле одну гидроксильную группу:
Многоатомные фенолы содержат в молекулах более одной гидроксильной группы:
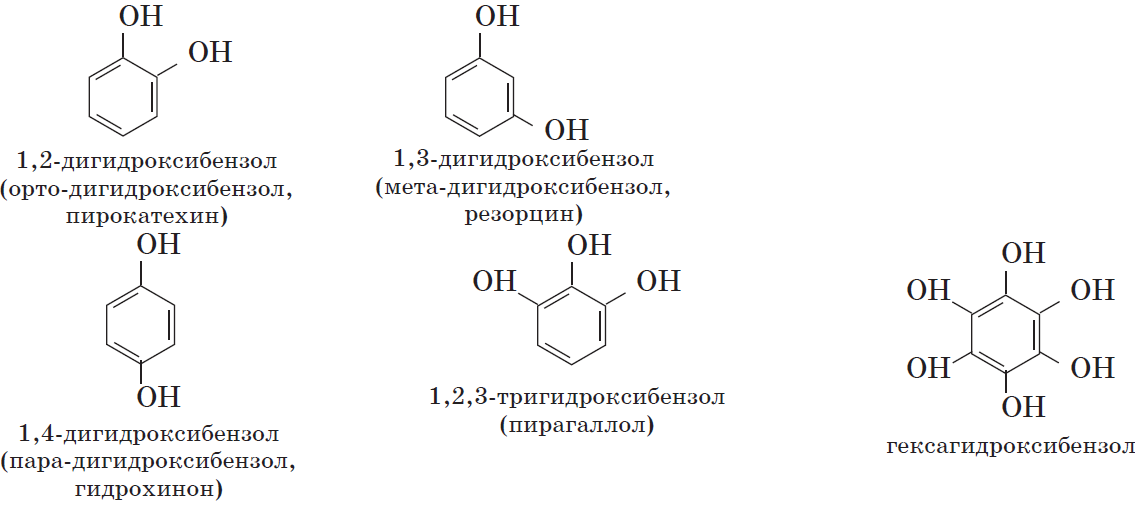
Существуют и другие многоатомные фенолы, содержащие три и более гидроксильные группы в бензольном кольце.
Познакомимся подробнее со строением и свойствами простейшего представителя этого класса — фенолом $С_6Н_5ОН$. Название этого вещества и легло в основу названия всего класса — фенолы.
Физические и химические свойства
Физические свойства.
Фенол — твердое, бесцветное, кристаллическое вещество, $t°_{пл.}=43°С, t°_{кип.}=181°С$, с резким характерным запахом. Ядовит. Фенол при комнатной температуре незначительно растворяется в воде. Водный раствор фенола называют карболовой кислотой. При попадании на кожу он вызывает ожоги, поэтому с фенолом необходимо обращаться осторожно!
Химические свойства.
Кислотные свойства. Как уже было сказано, атом водорода гидроксильной группы обладает кислотным характером. Кислотные свойства у фенола выражены сильнее, чем у воды и спиртов. В отличие от спиртов и воды, фенол реагирует не только с щелочными металлами, но и со щелочами с образованием фенолятов :
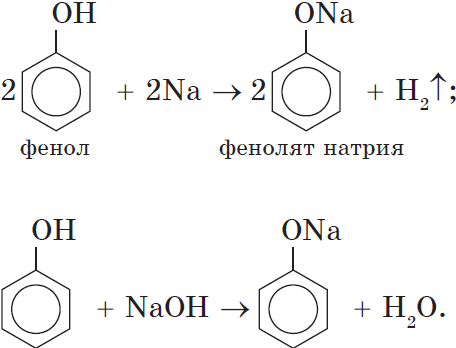
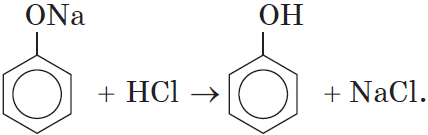
Однако кислотные свойства у фенолов выражены слабее, чем у неорганических и карбоновых кислот. Так, например, кислотные свойства фенола примерно в $3000$ раз слабее, чем у угольной кислоты. Поэтому, пропуская через водный раствор фенолята натрия углекислый газ, можно выделить свободный фенол:
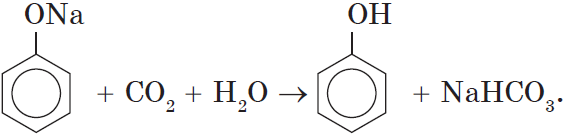
Добавление к водному раствору фенолята натрия соляной или серной кислоты также приводит к образованию фенола:
Качественная реакция на фенол.
Фенол реагирует с хлоридом железа (III) с образованием интенсивно окрашенного в фиолетовый цвет комплексного соединения.
Эта реакция позволяет обнаруживать его даже в очень ограниченных количествах. Другие фенолы, содержащие одну или несколько гидроксильных групп в бензольном кольце, также дают яркое окрашивание сине-фиолетовых оттенков в реакции с хлоридом железа (III).
Реакции бензольного кольца
Наличие гидроксильного заместителя значительно облегчает протекание реакций электрофильного замещения в бензольном кольце.
1. Бромирование фенола. В отличие от бензола, для бромирования фенола не требуется добавления катализатора (бромида железа (III)).
Кроме того, взаимодействие с фенолом протекает селективно (избирательно): атомы брома направляются в орто- и параположения, замещая находящиеся там атомы водорода. Селективность замещения объясняется рассмотренными выше особенностями электронного строения молекулы фенола.
Так, при взаимодействии фенола с бромной водой образуется белый осадок 2,4,6-трибромфенола:
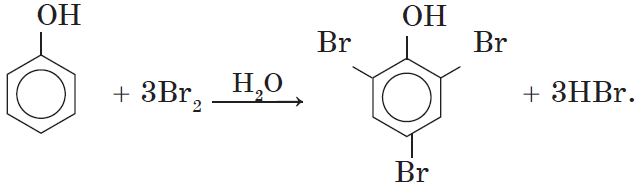
Эта реакция, так же, как и реакция с хлоридом железа (III), служит для качественного обнаружения фенола.
2. Нитрование фенола также происходит легче, чем нитрование бензола. Реакция с разбавленной азотной кислотой идет при комнатной температуре. В результате образуется смесь орто- и пара- изомеров нитрофенола:
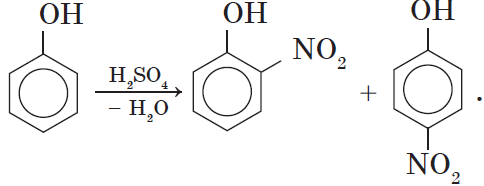
При использовании концентрированной азотной кислоты образуется взрывчатое вещество — 2,4,6-тринитрофенол (пикриновая кислота):
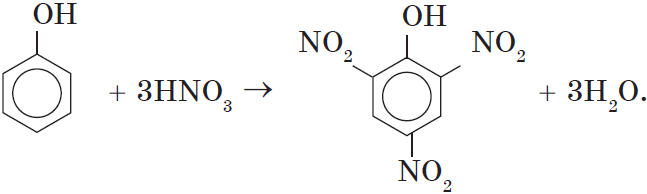
3. Гидрирование ароматического ядра фенола в присутствии катализатора происходит легко:
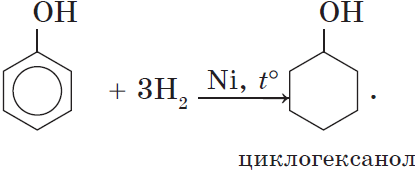
4. Поликонденсация фенола с альдегидами , в частности с формальдегидом, происходит с образованием продуктов реакции — фенолформальдегидных смол и твердых полимеров.
Взаимодействие фенола с формальдегидом можно описать схемой:
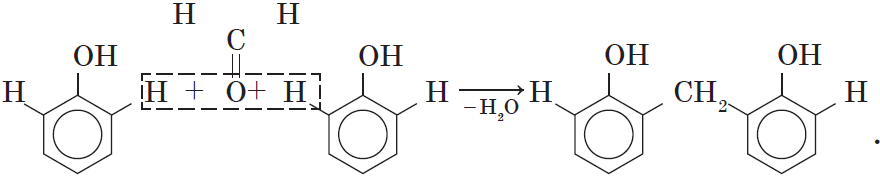
Вы, наверное, заметили, что в молекуле димера сохраняются «подвижные» атомы водорода, а значит, возможно дальнейшее продолжение реакции при достаточном количестве реагентов:
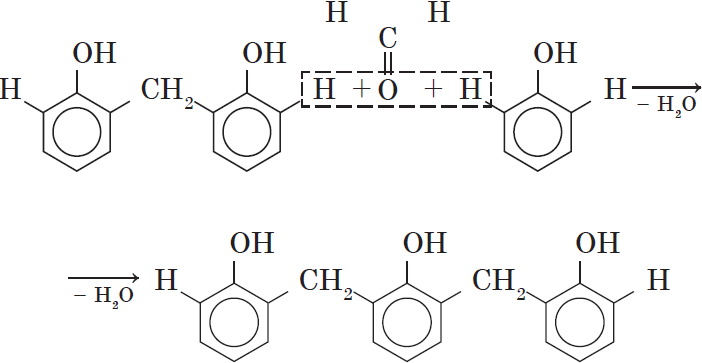
Реакция поликонденсации, т.е. реакция получения полимера, протекающая с выделением побочного низкомолекулярного продукта (воды), может продолжаться и далее (до полного израсходования одного из реагентов) с образованием огромных макромолекул. Процесс можно описать суммарным уравнением:
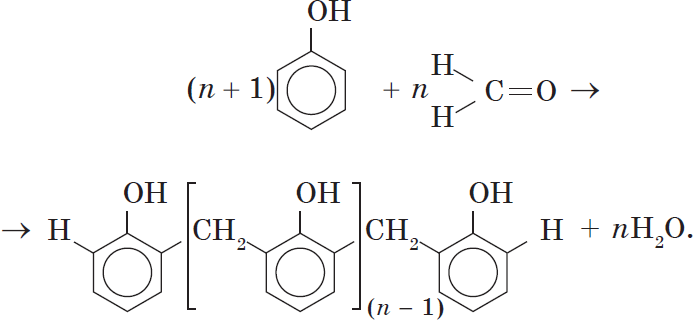
Образование линейных молекул происходит при обычной температуре. Проведение же этой реакции при нагревании приводит к тому, что образующийся продукт имеет разветвленное строение, он твердый и нерастворим в воде. В результате нагревания фенолформальдегидной смолы линейного строения с избытком альдегида получаются твердые пластические массы с уникальными свойствами. Полимеры на основе фенолформальдегидных смол применяют для изготовления лаков и красок, пластмассовых изделий, устойчивых к нагреванию, охлаждению, действию воды, щелочей и кислот, обладающих высокими диэлектрическими свойствами. Из полимеров на основе фенолформальдегидных смол изготавливают наиболее ответственные и важные детали электроприборов, корпуса силовых агрегатов и детали машин, полимерную основу печатных плат для радиоприборов. Клеи на основе фенолформальдегидных смол способны надежно соединять детали самой различной природы, сохраняя высочайшую прочность соединения в очень широком диапазоне температур. Такой клей применяется для крепления металлического цоколя ламп освещения к стеклянной колбе. Теперь вам понятно, почему фенол и продукты на его основе находят широкое применение.
Характерные химические свойства альдегидов, предельных карбоновых кислот, сложных эфиров
Альдегиды и кетоны
Альдегиды — органические вещества, молекулы которых содержат карбонильную группу 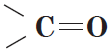 , соединенную с атомом водорода и углеводородным радикалом.
, соединенную с атомом водорода и углеводородным радикалом.
Общая формула альдегидов имеет вид:
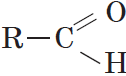
В простейшем альдегиде — формальдегиде — роль углеводородного радикала играет второй атом водорода:
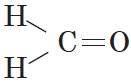
Карбонильную группу, связанную с атомом водорода, называют альдегидной:
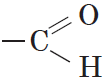
Органические вещества, в молекулах которых карбонильная группа связана с двумя углеводородными радикалами, называют кетонами.
Очевидно, общая формула кетонов имеет вид:
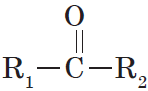
Карбонильную группу кетонов называют кетогруппой.
В простейшем кетоне — ацетоне — карбонильная группа связана с двумя метильными радикалами:
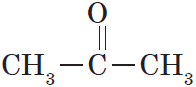
Номенклатура и изомерия
В зависимости от строения углеводородного радикала, связанного с альдегидной группой, различают предельные, непредельные, ароматические, гетероциклические и другие альдегиды:
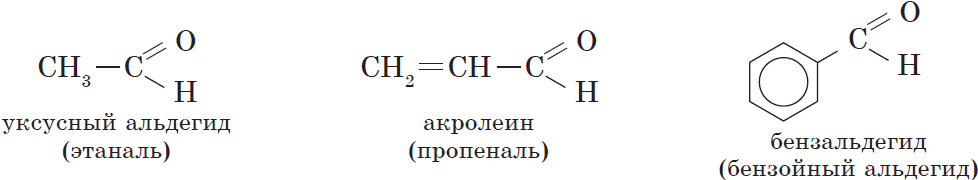
В соответствии с номенклатурой ИЮПАК названия предельных альдегидов образуются от названия алкана с тем же числом атомов углерода в молекуле с помощью суффикса -аль. Например:
Нумерацию атомов углерода главной цепи начинают с атома углерода альдегидной группы. По этому альдегидная группа всегда располагается при первом атоме углерода, и указывать ее положение нет необходимости.
Наряду с систематической номенклатурой используют и тривиальные названия широко применяемых альдегидов. Эти названия, как правило, образованы от названий карбоновых кислот, соответствующих альдегидам.
Для названия кетонов по систематической номенклатуре кетогруппу обозначают суффиксом -он и цифрой, которая указывает номер атома углерода карбонильной группы (нумерацию следует начинать от ближайшего к кетогруппе конца цепи). Например:
Для альдегидов характерен только один вид структурной изомерии — изомерия углеродного скелета, которая возможна с бутаналя, а для кетонов — также и изомерия положения карбонильной группы. Кроме этого, для них характерна и межклассовая изомерия (пропаналь и пропанон).
Тривиальные названия и температуры кипения некоторых альдегидов.
Физические и химические свойства
Физические свойства.
В молекуле альдегида или кетона вследствие большей электроотрицательности атома кислорода по сравнению с углеродным атомом связь $С=О$ сильно поляризована за счет смещения электронной плотности $π$-связи к кислороду:
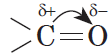
Альдегиды и кетоны — полярные вещества с избыточной электронной плотностью на атоме кислорода. Низшие члены ряда альдегидов и кетонов (формальдегид, уксусный альдегид, ацетон) растворимы в воде неограниченно. Их температуры кипения ниже, чем у соответствующих спиртов. Это связано с тем, что в молекулах альдегидов и кетонов, в отличие от спиртов, нет подвижных атомов водорода и они не образуют ассоциатов за счет водородных связей. Низшие альдегиды имеют резкий запах; у альдегидов, содержащих от четырех до шести атомов углерода в цепи, неприятный запах; высшие альдегиды и кетоны обладают цветочными запахами и применяются в парфюмерии.
Химические свойства
Наличие альдегидной группы в молекуле определяет характерные свойства альдегидов.
Реакции восстановления.
Присоединение водорода к молекулам альдегидов происходит по двойной связи в карбонильной группе:
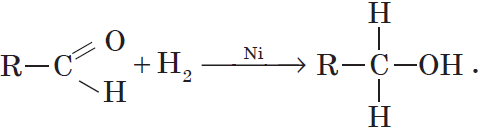
Продуктом гидрирования альдегидов являются первичные спирты, кетонов — вторичные спирты.
Так, при гидрировании уксусного альдегида на никелевом катализаторе образуется этиловый спирт, при гидрировании ацетона — пропанол-2:
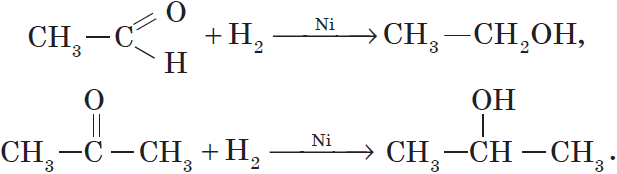
Гидрирование альдегидов — реакция восстановления, при которой понижается степень окисления атома углерода, входящего в карбонильную группу.
Реакции окисления.
Альдегиды способны не только восстанавливаться, но и окисляться. При окислении альдегиды образуют карбоновые кислоты. Схематично этот процесс можно представить так:
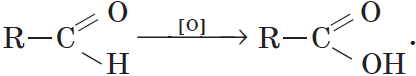
Из пропионового альдегида (пропаналя), например, образуется пропионовая кислота:
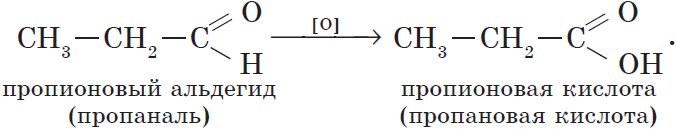
Альдегиды окисляются даже кислородом воздуха и такими слабыми окислителями, как аммиачный раствор оксида серебра. В упрощенном виде этот процесс можно выразить уравнением реакции:
Например:
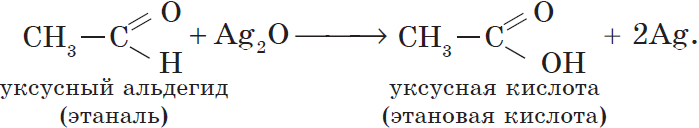
Более точно этот процесс отражают уравнения:
Если поверхность сосуда, в котором проводится реакция, была предварительно обезжирена, то образующееся в ходе реакции серебро покрывает ее ровной тонкой пленкой. Поэтому эту реакцию называют реакцией «серебряного зеркала» . Ее широко используют для изготовления зеркал, серебрения украшений и елочных игрушек.
Окислителем альдегидов может выступать и свежеосажденный гидроксид меди (II). Окисляя альдегид, $Cu^{2+}$ восстанавливается до $Cu^+$. Образующийся в ходе реакции гидроксид меди (I) $CuOH$ сразу разлагается на оксид меди (I) красного цвета и воду:
Эта реакция, так же, как и реакция «серебряного зеркала», используется для обнаружения альдегидов.
Кетоны не окисляются ни кислородом воздуха, ни таким слабым окислителем, как аммиачный раствор оксида серебра.
Отдельные представители альдегидов и их значение
Формальдегид (метаналь, муравьиный альдегид $HCHO$) — бесцветный газ с резким запахом и температурой кипения $-21С°$, хорошо растворим в воде. Формальдегид ядовит! Раствор формальдегида в воде ($40%$) называют формалином и применяют для дезинфекции. В сельском хозяйстве формалин используют для протравливания семян, в кожевенной промышленности — для обработки кож. Формальдегид используют для получения уротропина — лекарственного вещества. Иногда спрессованный в виде брикетов уротропин применяют в качестве горючего (сухой спирт). Большое количество формальдегида расходуется при получении фенолформальдегидных смол и некоторых других веществ.
Уксусный альдегид (этаналь, ацетальдегид $CH_3CHO$) — жидкость с резким неприятным запахом и температурой кипения $21°С$, хорошо растворим в воде. Из уксусного альдегида в промышленных масштабах получают уксусную кислоту и ряд других веществ, он используется для производства различных пластмасс и ацетатного волокна. Уксусный альдегид ядовит!
Карбоновые кислоты
Вещества, содержащие в молекуле одну или несколько карбоксильных групп, называются карбоновыми кислотами.
Группа атомов 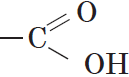 называется карбоксильной группой
, или карбоксилом.
называется карбоксильной группой
, или карбоксилом.
Органические кислоты, содержащие в молекуле одну карбоксильную группу, являются одноосновными.
Общая формула этих кислот $RCOOH$, например:
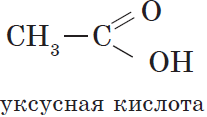
Карбоновые кислоты, содержащие две карбоксильные группы, называются двухосновными. К ним относятся, например, щавелевая и янтарная кислоты:
Существуют и многоосновные карбоновые кислоты, содержащие более двух карбоксильных групп. К ним относится, например, трехосновная лимонная кислота:
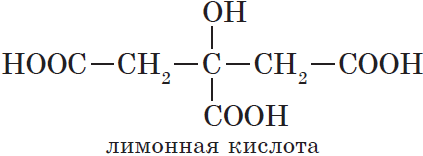
В зависимости от природы углеводородного радикала карбоновые кислоты делятся на предельные, непредельные, ароматические.
Предельными, или насыщенными, карбоновыми кислотами являются, например, пропановая (пропионовая) кислота:
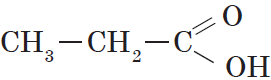
или уже знакомая нам янтарная кислота.
Очевидно, что предельные карбоновые кислоты не содержат $π$-связей в углеводородном радикале. В молекулах непредельных карбоновых кислот карбоксильная группа связана с ненасыщенным, непредельным углеводородным радикалом, например, в молекулах акриловой (пропеновой) $СН_2=СН—СООН$ или олеиновой $СН_3—(СН_2)_7—СН=СН—(СН_2)_7—СООН$ и других кислот.
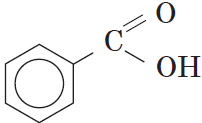
Как видно из формулы бензойной кислоты, она является ароматической, так как содержит в молекуле ароматическое (бензольное) кольцо:
Номенклатура и изомерия
Общие принципы образования названий карбоновых кислот, как и других органических соединений, уже рассматривались. Остановимся подробнее на номенклатуре одно- и двухосновных карбоновых кислот. Название карбоновой кислоты образуется от названия соответствующего алкана (алкана с тем же числом атомов углерода в молекуле) с добавлением суффикса -ов- , окончания -ая и слова кислота. Нумерация атомов углерода начинается с карбоксильной группы. Например:
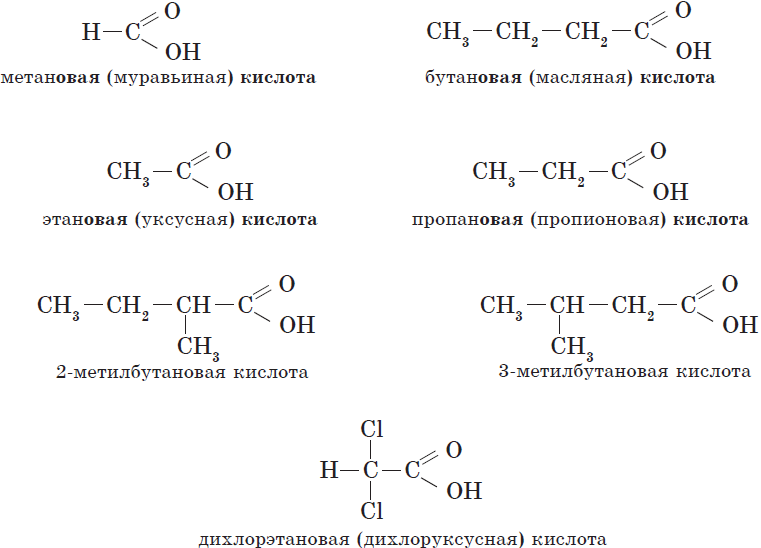
Количество карбоксильных групп указывается в названии префиксами ди-, три-, тетра- :
Многие кислоты имеют и исторически сложившиеся, или тривиальные, названия.
Названия карбоновых кислот.
| Химическая формула | Систематическое название кислоты | Тривиальное название кислоты |
| $Н—СООН$ | Метановая | Муравьиная |
| $СН_3—СООН$ | Этановая | Уксусная |
| $СН_3—СН_2—СООН$ | Пропановая | Пропионовая |
| $СН_3—СН_2—СН_2—СООН$ | Бутановая | Масляная |
| $СН_3—СН_2—СН_2—СН_2—СООН$ | Пентановая | Валериановая |
| $СН_3—(СН_2)_4—СООН$ | Гексановая | Капроновая |
| $СН_3—(СН_2)_5—СООН$ | Гептановая | Энантовая |
| $НООС—СООН$ | Этандиовая | Щавелевая |
| $НООС—СН_2—СООН$ | Пропандиовая | Малоновая |
| $НООС—СН_2—СН_2—СООН$ | Бутандиовая | Янтарная |
После знакомства с многообразным и интересным миром органических кислот рассмотрим более подробно предельные одноосновные карбоновые кислоты.
Понятно, что состав этих кислот выражается общей формулой $С_nН_{2n}О_2$, или $С_nН_{2n+1}СООН$, или $RCOOH$.
Физические и химические свойства
Физические свойства.
Низшие кислоты, т.е. кислоты с относительно небольшой молекулярной массой, содержащие в молекуле до четырех атомов углерода, — жидкости с характерным резким запахом (вспомните запах уксусной кислоты). Кислоты, содержащие от $4$ до $9$ атомов углерода, — вязкие маслянистые жидкости с неприятным запахом; содержащие более $9$ атомов углерода в молекуле — твердые вещества, не растворяющиеся в воде. Температуры кипения предельных одноосновных карбоновых кислот увеличиваются с ростом числа атомов углерода в молекуле и, следовательно, с ростом относительной молекулярной массы. Так, например, температура кипения муравьиной кислоты равна $100,8°С$, уксусной — $118°С$, пропионовой — $141°С$.
Простейшая карбоновая кислота — муравьиная $НСООН$, имея небольшую относительную молекулярную массу $(M_r(HCOOH)=46)$, при обычных условиях является жидкостью с температурой кипения $100,8°С$. В то же время бутан $(M_r(C_4H_{10})=58)$ в тех же условиях газообразен и имеет температуру кипения $-0,5°С$. Это несоответствие температур кипения и относительных молекулярных масс объясняется образованием димеров карбоновых кислот, в которых две молекулы кислоты связаны двумя водородными связями:
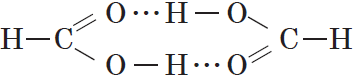
Возникновение водородных связей становится понятным при рассмотрении строения молекул карбоновых кислот.
Молекулы предельных одноосновных карбоновых кислот содержат полярную группу атомов — карбоксил 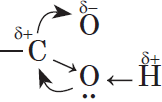 и практически неполярный углеводородный радикал. Карбоксильная группа притягивается молекулами воды, образуя с ними водородные связи:
и практически неполярный углеводородный радикал. Карбоксильная группа притягивается молекулами воды, образуя с ними водородные связи:
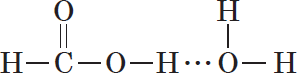
Муравьиная и уксусная кислоты растворимы в воде неограниченно. Очевидно, что с увеличением числа атомов в углеводородном радикале растворимость карбоновых кислот снижается.
Химические свойства.
Общие свойства, характерные для класса кислот (как органических, так и неорганических), обусловлены наличием в молекулах гидроксильной группы, содержащей сильную полярную связь между атомами водорода и кислорода. Рассмотрим эти свойства на примере растворимых в воде органических кислот.
1. Диссоциация с образованием катионов водорода и анионов кислотного остатка:
$CH_3-COOH⇄CH_3-COO^{-}+H^+$
Более точно этот процесс описывает уравнение, учитывающее участие в нем молекул воды:
$CH_3-COOH+H_2O⇄CH_3COO^{-}+H_3O^+$
Равновесие диссоциации карбоновых кислот смещено влево; подавляющее большинство их — слабые электролиты. Тем не менее, кислый вкус, например, уксусной и муравьиной кислот объясняется диссоциацией на катионы водорода и анионы кислотных остатков.
Очевидно, что присутствием в молекулах карбоновых кислот «кислого» водорода, т.е. водорода карбоксильной группы, обусловлены и другие характерные свойства.
2. Взаимодействие с металлами , стоящими в электрохимическом ряду напряжений до водорода: $nR-COOH+M→(RCOO)_{n}M+{n}/{2}H_2$
Так, железо восстанавливает водород из уксусной кислоты:
$2CH_3-COOH+Fe→(CH_3COO)_{2}Fe+H_2$
3. Взаимодействие с основными оксидами с образованием соли и воды:
$2R-COOH+CaO→(R-COO)_{2}Ca+H_2O$
4. Взаимодействие с гидроксидами металлов с образованием соли и воды (реакция нейтрализации):
$R—COOH+NaOH→R—COONa+H_2O$,
$2R—COOH+Ca(OH)_2→(R—COO)_{2}Ca+2H_2O$.
5. Взаимодействие с солями более слабых кислот с образованием последних. Так, уксусная кислота вытесняет стеариновую из стеарата натрия и угольную из карбоната калия:
$CH_3COOH+C_{17}H_{35}COONa→CH_3COONa+C_{17}H_{35}COOH↓$,
$2CH_3COOH+K_2CO_3→2CH_3COOK+H_2O+CO_2$.
6. Взаимодействие карбоновых кислот со спиртами с образованием сложных эфиров — реакция этерификации (одна из наиболее важных реакций, характерных для карбоновых кислот):
Взаимодействие карбоновых кислот со спиртами катализируется катионами водорода.
Реакция этерификации обратима. Равновесие смещается в сторону образования сложного эфира в присутствии водоотнимающих средств и при удалении эфира из реакционной смеси.
В реакции, обратной этерификации, которая называется гидролизом сложного эфира (взаимодействие сложного эфира с водой), образуются кислота и спирт:
Очевидно, что реагировать с карбоновыми кислотами, т.е. вступать в реакцию этерификации, могут и многоатомные спирты, например глицерин:
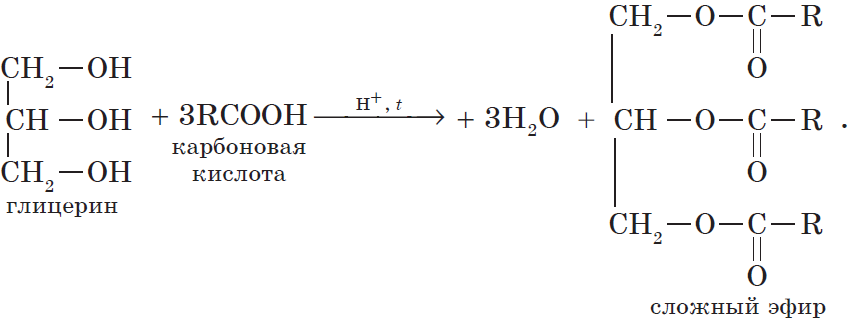
Все карбоновые кислоты (кроме муравьиной) наряду с карбоксильной группой содержат в молекулах углеводородный остаток. Безусловно, это не может не сказаться на свойствах кислот, которые определяются характером углеводородного остатка.
7. Реакции присоединения по кратной связи — в них вступают непредельные карбоновые кислоты. Например, реакция присоединения водорода — гидрирование . Для кислоты, содержащей в радикале одну $π$-связь, можно записать уравнение в общем виде:
$C_{n}H_{2n-1}COOH+H_2{→}↖{катализатор}C_{n}H_{2n+1}COOH.$
Так, при гидрировании олеиновой кислоты образуется предельная стеариновая кислота:
${C_{17}H_{33}COOH+H_2}↙{\text"олеиновая кислота"}{→}↖{катализатор}{C_{17}H_{35}COOH}↙{\text"стеариновая кислота"}$
Непредельные карбоновые кислоты, как и другие ненасыщенные соединения, присоединяют галогены по двойной связи. Так, например, акриловая кислота обесцвечивает бромную воду:
${CH_2=CH—COOH+Br_2}↙{\text"акриловая(пропеновая)кислота"}→{CH_2Br—CHBr—COOH}↙{\text"2,3-дибромпропановая кислота"}.$
8. Реакции замещения (с галогенами) — в них способны вступать предельные карбоновые кислоты. Например, при взаимодействии уксусной кислоты с хлором могут быть получены различные хлорпроизводные кислоты:
$CH_3COOH+Cl_2{→}↖{Р(красный)}{CH_2Cl-COOH+HCl}↙{\text"хлоруксусная кислота"}$,
$CH_2Cl-COOH+Cl_2{→}↖{Р(красный)}{CHCl_2-COOH+HCl}↙{\text"дихлоруксусная кислота"}$,
$CHCl_2-COOH+Cl_2{→}↖{Р(красный)}{CCl_3-COOH+HCl}↙{\text"трихлоруксусная кислота"}$
Отдельные представители карбоновых кислот и их значение
Муравьиная (метановая) кислота ХЦООХ — жидкость с резким запахом и температурой кипения $100.8°С$, хорошо растворима в воде. Муравьиная кислота ядовита, при попадании на кожу вызывает ожоги! Жалящая жидкость, выделяемая муравьями, содержит эту кислоту. Муравьиная кислота обладает дезинфицирующим свойством и поэтому находит свое применение в пищевой, кожевенной и фармацевтической промышленности, медицине. Она используется при крашении тканей и бумаги.
Уксусная (этановая) кислота $CH_3COOH$ — бесцветная жидкость с характерным резким запахом, смешивается с водой в любых cоотношениях. Водные растворы уксусной кислоты поступают в продажу под названием уксуса ($3-5%$-ный раствор) и уксусной эссенции ($70-80%$-ный раствор) и широко используются в пищевой промышленности. Уксусная кислота — хороший растворитель многих органических веществ и поэтому используется при крашении, в кожевенном производстве, в лакокрасочной промышленности. Кроме этого, уксусная кислота является сырьем для получения многих важных в техническом отношении органических соединений: например, на ее основе получают вещества, используемые для борьбы с сорняками, — гербициды.
Уксусная кислота является основным компонентом винного уксуса, характерный запах которого обусловлен именно ею. Она — продукт окисления этанола и образуется из него при хранении вина на воздухе.
Важнейшими представителями высших предельных одноосновных кислот являются пальмитиновая $C_{15}H_{31}COOH$ и стеариновая $C_{17}H_{35}COOH$ кислоты. В отличие от низших кислот, эти вещества твердые, плохо растворимы в воде.
Однако их соли — стеараты и пальмитаты — хорошо растворимы и обладают моющим действием, поэтому их еще называют мылами. Понятно, что эти вещества производят в больших масштабах. Из непредельных высших карбоновых кислот наибольшее значение имеет олеиновая кислота $C_{17}H_{33}COOH$, или $CH_3 — (CH_2)_7 — CH=CH —(CH_2)_7COOH$. Это маслоподобная жидкость без вкуса и запаха. Широкое применение в технике находят ее соли.
Простейшим представителем двухосновных карбоновых кислот является щавелевая (этандиовая) кислота $HOOC—COOH$, соли которой встречаются во многих растениях, например в щавеле и кислице. Щавелевая кислота — это бесцветное кристаллическое вещество, хорошо растворяется в воде. Она применяется при полировке металлов, в деревообрабатывающей и кожевенной промышленности.
Сложные эфиры
При взаимодействии карбоновых кислот со спиртами (реакция этерификации) образуются сложные эфиры:
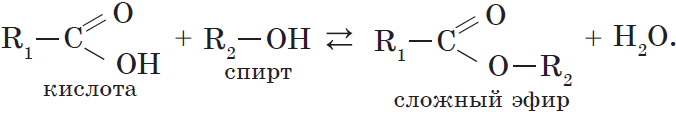
Эта реакция обратима. Продукты реакции могут взаимодействовать друг с другом с образованием исходных веществ — спирта и кислоты. Таким образом, реакция сложных эфиров с водой — гидролиз сложного эфира — обратна реакции этерификации. Химическое равновесие, устанавливающееся при равенстве скоростей прямой (этерификация) и обратной (гидролиз) реакций, может быть смещено в сторону образования эфира присутствием водоотнимающих средств.
Жиры — производные соединения, которые представляют собой сложные эфиры глицерина и высших карбоновых кислот.
Все жиры, как и другие сложные эфиры, подвергаются гидролизу:
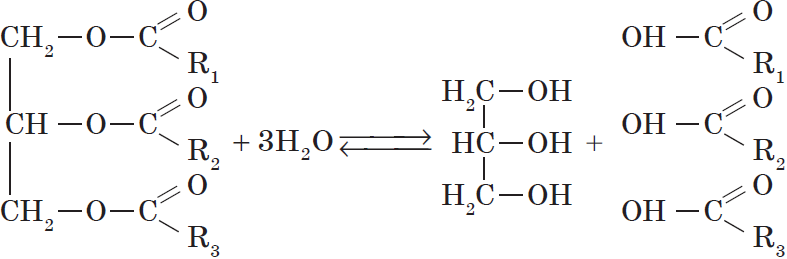
При проведении гидролиза жира в щелочной среде $(NaOH)$ и в присутствии кальцинированной соды $Na_2CO_3$ он протекает необратимо и приводит к образованию не карбоновых кислот, а их солей, которые называются мылами. Поэтому гидролиз жиров в щелочной среде называются омылением.
Твой план подготовки к ЕГЭ 2018 почти готов
Построить свой план
Введение
Краткий исторический обзор развития органической химии
Первые теоретические воззрения
Теория строения А.М. Бутлерова
Способы изображения органических молекул, пространственные модели
Типы углеродного скелета
Изомерия, гомология, изология
Классы органических соединений
Основы номенклатуры в органической химии
Литература
Введение
Органическая химия может быть определена как химия углеводородов и их производных. Хотя такое определение весьма четко отражает содержание предмета органической химии, оно не дает возможности провести резкую границу между органическими и неорганическими веществами. Так как в природе все явления взаимосвязаны, то естественно, что грубое отсечение одной отрасли науки от другой невозможно. Между смежными науками существуют естественные диалектические переходы. Так, на границе между органическими и неорганическими соединениями находятся вещества сода, сероуглерод, мочевина, оксид углерода (IV) и т. д., некоторые из которых можно с равным правом рассматривать в качестве как органических, так и неорганических соединений.
Место органической химии в ряду других наук определяется не только ее генетическими связями с неорганической химией. Изучая и синтезируя сложнейшие органические вещества, играющие важную роль в жизнедеятельности животных и растительных организмов, органическая химия тесно соприкасается и с биологией. В пограничной между этими двумя науками области возникла и успешно развивается молодая наука - биологическая химия. Наконец, вследствие все расширяющегося в настоящее время применения физических методов исследования органических веществ, теснее становится связь органической химии с физикой.
Среди причин выделения органической химии в отдельную науку можно выделить следующие:
Число известных органических соединений (около 16 млн) значительно превышает число соединений всех остальных элементов периодической системы Менделеева. В настоящее время известно около 700 тыс. неорганических соединений, в то же время, примерно 150 тыс. новых органических соединений получают сейчас в один год. Это объясняется не только тем, что химики особенно интенсивно занимаются синтезом и исследованием органических соединений, но и особой способностью элемента углерода давать соединения, содержащие практически неограниченное число атомов углерода, связанных в цепи и циклы между собой и с атомами других элементов.
Органические вещества имеют исключительное значение вследствие их крайне многообразного практического применения, а особенно потому, что они играют важную роль в процессах жизнедеятельности организмов.
Имеются существенные отличия в свойствах и реакционной способности органических соединений от неорганических, вследствие чего возникла необходимость в развитии многих специфических методов исследования органических соединений.
1. Краткий исторический обзор развития органической химии
Интересным представляется вопрос, как появились на Земле органические вещества. Существует несколько теорий. Так, химическая теория происхождения жизни на Земле (А. Опарин, 1922) утверждает, что органические молекулы, которые затем самообразовались в живые организмы, возникли в результате абиогенного синтеза.
Более 5 млрд. лет назад произошла вспышка сверхновой звезды, которая дала материал для образования солнечной системы. Облако космической пыли - юная Земля - состояло из металлов и их оксидов, воды, аммонийных, кремниевых, сернистых соединений, карбидов. Под действием гравитационных сил это облако сжималось, температура повышалась и протекали химические реакции, что ускорило рост температуры. Образовалось плотное расплавленное ядро, мантия и кора. Летучие вещества образовали первичную атмосферу, которая содержала метан, аммиак, пары воды. Кислорода в первичной атмосфере Земли не было. Пары воды при остывания коры сконденсировались и образовали океаны. Скалы и океаны составляли рельеф Земли, который обжигало Солнце. Его излучение несло УФ составляющую, которая теперь в значительной степени поглощается озоном. Энергия УФ излучения способна превращать одни молекулы в другие (фотолиз). Наиболее важными являются молекулы двух соединений, образовавшихся в результате фотолиза - формальдегид (из метана и воды)
и циановодород (из метана и аммиака)
Синтез формальдегида и аммиака в первичном океане дает ключ к разгадке тайны появления основных составляющих жизни - белков и нуклеиновых кислот. Белки состоят из остатков аминокислот. Простейшей аминокислотой является глицин (аминоуксусная кислота).
Другие аминокислоты содержат заместитель вместо одного из водородов при атоме углерода. Например, если этот заместитель метил, то кислота - аланин, бензил - фенилаланин и т.д. Белковые молекулы образуются в результате конденсации аминогруппы молекулы одной кислоты с карбоксильной группой другой. Вот пример идеального пути образования трипептида, который в реальности не имеет места.
В 1953 году была осуществлена экспериментальная проверка возможности самопроизвольного возникновения аминокислот в условиях, которые должны были быть в первичной атмосфере Земли. Миллер (Чикагский университет) в течение недели подвергал действию электрического разряда смесь метана, аммиака, воды и водорода. После этого в смеси были обнаружены глицин и другие аминокислоты. При этом более 2% метана превратились в глицин.
В 1970 году в метеорите, упавшем в Австралии, были обнаружены аминокислоты, шесть из которых аналогичны тем, которые встречаются в живой материи, существующей на Земле. Либо эти аминокислоты образовались где-то во Вселенной абиогенным путем, либо существует внеземная жизнь. Однако аминокислоты в живой природе на Земле оптически активны, обнаруженные же в метеорите и синтезированные в результате электрического разряда оптической активности не проявляют. Оптическая активность обусловлена внутренней асимметрией молекул. Она проявляется способностью раствора вещества поворачивать плоскость поляризации света по часовой стрелке или против нее на определенный угол. Если атом углерода имеет четыре разных заместителя, то они могут располагаться двояким способом, давая структуры, относящиеся друг к другу, как предмет к своему зеркальному отражению (оптические антиподы, энантиомеры). Смесь, содержащая одинаковое количество тех и других молекул, оптически неактивна (рацемат).
Аминокислота, выделенная из белков, всегда поворачивает плоскость поляризации света влево. Получение аминокислот в лаборатории из подходящих реактивов приводит к образованию рацемата.
В отличие от белков нуклеиновые кислоты состоят из нуклеотидов, каждый из которых содержит остатки трех химических соединений: пуринового или пиримидинового основания,
фосфорной кислоты
и сахарида (рибозы или дезоксирибозы).
Эти три компонента, соединяясь друг с другом, образуют нуклеотид.
Из многих нуклеотидов строится цепочка нуклеиновой кислоты.
Сахара, пиримидиновые и пуриновые основания, вероятно, возникли из простых молекул циановодорода, формальдегида, аммиака и воды до появления жизни на Земле. В молекулы ДНК входят всего четыре основания: два пиримидиновых: цитозин и тимин, два - пуриновых: аденин и гуанин.
Посредством приведенных выше простых реакций невозможно объяснить факта происхождения оптически активных молекул аминокислот, сахаров. Можно предположить, что в добиологический период существовали минералы, на поверхности которых происходил синтез оптически активных молекул, после появления однажды которых можно ожидать образование и других соединений, обладающих оптической активностью.
Органическая химия как наука оформилась в начале XIX в., однако знакомство человека с органическими веществами и применение их для практических целей началось еще в глубокой древности. Первой известной кислотой был уксус или водный раствор уксусной кислоты. Древним народам было известно брожение виноградного сока, они знали примитивный способ перегонки и применяли его для получения скипидара; галлы и германцы знали способы варки мыла; в Египте, Галлии и Германии умели варить пиво. В Индии, Финикии и Египте было весьма развито искусство крашения тканей и других материалов при помощи органических веществ. Древние народы пользовались такими органическими веществами как масла, жиры, сахар, крахмал, камедь, смолы, индиго и др.
Период развития химических знаний в средние века (приблизительно до XVI в.) получил название периода алхимии. Однако в это время изучение неорганических веществ было значительно более успешным, чем изучение веществ органических. Сведения о свойствах последних остались почти столь же ограниченными, как и в более древние века. Некоторый шаг вперед был сделан благодаря совершенствованию методов перегонки. Таким путем, в частности, было выделено несколько эфирных масел и получен крепкий винный спирт, считавшийся одним из веществ, с помощью которых можно приготовить философский камень.
Конец XVIII в. ознаменовался заметными успехами в изучении органических веществ, причем органические вещества начали исследовать с чисто научной точки зрения. В этот период был выделен из растений и описан ряд важнейших органических кислот (щавелевая, лимонная, яблочная, галловая) и установлено, что растительные масла и жир животных содержат в качестве общей составной части «сладкое начало масел» (глицерин) и т.д.
Примерно до середины позапрошлого века весь окружающий мир веществ делился на органические и минеральные, т.е. принадлежащие к неживой природе.
В начале XIX века были попытки отделить органическую химию от неорганической на основании глубоких отличий в свойствах веществ. Органические вещества, как правило, более сложны, они менее устойчивы, чем минеральные (горение дерева, масла, прогоркание масел, окисление вина в уксус и т.д.). Й.Берцелиус еще в 1806 году впервые употребил термин "органическая химия", а в 1827 году он писал, что "в живой природе элементы повинуются иным законам, чем в безжизненной". Он предложил теорию, согласно которой органические вещества не могут образовываться под влиянием обычных физических и химических сил, но требуют для своего образования особой "жизненной силы" ("vis vitalis"). Это учение, известное под именем Теории витализма, утверждало, что химики могут готовить новые органические вещества из других органических веществ, но из минеральных этого сделать невозможно.
Однако в 1824 году ученик Берцелиуса Фридрих Вёлер получил щавелевую кислоту путем нагревания с водой типично минерального вещества дициана.
Правда, ни он, ни ученый мир не смогли увидеть принципиального значения этого факта. В 1828 году Велер показал, что неорганическое вещество - циановокислый аммоний - при нагревании превращается в органическое вещество - мочевину.
Несмотря на то, что факт получения мочевины без участия живого организма не мог поколебать убеждения виталистов, реакция имеет большое значение как первая реакция органического синтеза и она считается началом синтетической органической химии. В 1845 году Кольбе из древесного угля, хлора, серы и воды получил другое органическое вещество - уксусную кислоту, в 1861 году Бутлеров в результате обработки полимера формальдегида известковой водой осуществил синтез метиленитана - вещества, относящего к классу сахаров (a-акроза) , в 1862 году Бертело из угля и водорода получил ацетилен. Постепенно начали развиваться исследования органических веществ - продуктов жизнедеятельности животных организмов. Так, например, из мочи человека были выделены мочевина и мочевая кислота, а из мочи коровы и лошади - гиппуровая кислота и установлено их строение.
Накопление значительного фактического материала явилось сильным толчком к более глубокому изучению органического вещества. Результаты научных открытий привели к краху витализма - идеалистического учения о «жизненной силе».
2. Первые теоретические воззрения
Теория радикалов. Первая теория в органической химии - теория радикалов - была тесно связана с электрохимической теорией Берцелиуса. Основываясь главным образом на факте электролиза неорганических соединений, Берцелиус считал, что все химические вещества состоят из электроотрицательных и электроположительных атомов или групп атомов, удерживаемых в молекуле силами электростатического притяжения. Теория радикалов представляла собой фактически модификацию электрохимической теории Берцелиуса применительно к органической химии.
Экспериментальным основанием для создания теории радикалов послужили исследования соединений циана, проведенные Гей-Люссаком в 1815 году. Впервые было установлено, что в ряде химических превращений группа из нескольких атомов в неизменном виде переходит из молекулы одного вещества в молекулу другого, подобно тому как переходят из молекулы в молекулу атомы элементов. Такие «неизменяемые» группы атомов получили название радикалов.
Мощной поддержкой теории радикалов оказались осуществленные позднее (1832) Либихом и Вёлером исследования «горько-миндального масла» - вещества, которое теперь называется бензойным альдегидом С7Н6О. При изучении реакций этого вещества был получен ряд соединений, неизменно содержащих в своей молекуле группу атомов С7Н5О, названную ими радикалом «бензоилом»:
С7Н5О-Н - водородистый бензоил (бензойный альдегид);
С7Н5О-С1 - хлористый бензоил;
С7Н5О-ОН - гидрат окиси бензоила (бензойная кислота);
С7Н5О-ONa - бензойнонатриевая соль и т. д.
Результаты исследований были восприняты как доказательство того, что органические вещества состоят из радикалов, точно так же, как неорганические вещества - из атомов.
На определенном этапе развития органической химии теория радикалов сыграла значительную роль, впервые дав химикам руководящую нить в исследовании органического вещества. Это оказалось возможным потому, что в основе теории радикалов лежало очень важное обобщение: при химических реакциях группы атомов (т. е. радикалы) в неизменном виде входят в образующиеся при этих реакциях молекулы.
Вместе с тем теория радикалов имела и ряд принципиальных недостатков. Решающим ударом по теории радикалов явилось открытие французским химиком Дюма химических реакций, при которых легко изменялись некоторые из наиболее обычных радикалов. Он открыл, что атомы хлора могут замещать в молекулах органического вещества атомы водорода - реакция металепсии.
При действии хлора на уксусную кислоту атом водорода в радикале ацетиле легко замещался на атом хлора, причем получающееся вещество по химическим свойствам мало отличалось от уксусной кислоты:
С2Н3О-OH + Cl2 = С2Н2С1О-ОН + НСl; C2Cl3O-OH
При действии хлора на полученное вещество легко происходило дальнейшее замещение второго, а затем и третьего атома водорода на атом хлора. Соединения, получившиеся в результате этих реакций, по химическим свойствам также мало отличались как от хлоруксусной, так и от уксусной кислоты.
Таким образом, при подобных реакциях не только изменялся сам радикал, но, кроме того, замена электроположительного водорода на электроотрицательный хлор мало влияла на химические свойства соединения.
Теория типов
Теория радикалов обращала внимание, главным образом, на ту часть молекулы органических веществ, которая при обычных химических превращениях оставалась неизменной. Меньше внимания уделялось легко изменяющейся части молекулы и причинам ее изменений. Сменившая теорию радикалов теория типов, наоборот, обратила внимание именно на наиболее изменчивые части молекулы и на причины этой изменчивости. Теория типов подчеркивала, что в реакциях органических веществ обнаруживается сходство с реакциями простейших неорганических соединений. Органические вещества предлагалось рассматривать образованными от простейших неорганических веществ путем замещения в последних одного или нескольких атомов на разные органические группы, названные «остатками» (чтобы не употреблять отвергнутого слова «радикал»). При этом простейшие неорганические вещества являлись для образованных от них органических веществ типами в том смысле, что молекулы этих органических веществ обладали характерными, «типичными», реакциями исходных неорганических молекул.
Основоположник теории типов Жерар предложил разделить органические вещества на группы, близкие по своему типу к воде, хлороводороду, аммиаку. Несколько позднее Кекуле ввел и тип метана, тип воды, тип хлороводорода, тип аммиака.
Приведенные типические формулы показывают, например, что, заменяя в молекуле воды один атом водорода на остаток СН3, можно получить метиловый спирт, заменяя оба атома водорода - диметиловый эфир и т. д. Аналогичные группы составляют вещества типа НСl, NH3 и т. д.
Согласно теории типов, различные радикалы, образующие молекулу, не обладают двумя противоположными зарядами; в связи с этим система Жерара получила название «унитарной системы» в противоположность представлениям Берцелиуса, которые легли в основание теории радикалов.
Сходство органических соединений с неорганическими, лежащими в основе данного типа, заключается не только в составе и способах получения, но и в ряде свойств. Например, металлический натрий реагирует со спиртом так же, как с водой:
Сходство органических соединений с некоторыми типичными неорганическими позволило в известной степени предсказывать свойства вновь открываемых органических соединений, если удавалось отнести их к определенному типу.
По мере дальнейшего накопления экспериментального материала, рамки теории типов становились тесными для развития органической химии.
Сторонники теории типов, пытаясь спасти ее, начали вводить усложнения. Во многих случаях одно и то же соединение изображали десятками типических формул.
По мере открытия новых свойств соединения число типических формул для него увеличивалось.
Теория типов зашла в тупик; она была способна идти только за экспериментом, а в предсказательном отношении была беспомощна.
. Теория строения А.М. Бутлерова
Ни теория радикалов, ни теория типов не могли дать ответа на вопрос: являются ли молекулы беспорядочным нагромождением атомов, удерживаемых силами притяжения, или они представляют собой частицы с определенным строением, которое можно установить, исследуя свойства вещества. В органической химии к этому времени уже накопились факты и обобщения, которые могли служить основой для решения вопроса о строении молекул.
Решающую роль сыграло открытие валентности элементов. Франкланд (1853) нашел, что каждый металл дает соединения со строго определенным числом органических радикалов; это число и представляет собой валентность данного металла. Так, были получены следующие соединения:
CH3Na(CH3)2Hg(CH3)3Al(CH3)4Snметилнатрийдиметилртутьтриметилалюминийтетраметилолово
Стало ясно, что атомы могут соединяться в молекулы только в отношениях, разрешенных валентностью атомов. Было установлено, что углерод четырехвалентен (Август Кекуле, 1858).
Понятие валентности подводило к мысли о том, что молекулы имеют определенное строение, но открытым оставался вопрос, как определять строение молекулы. Ответ на него дала теория А.М.Бутлерова.
Основная идея была сформулирована им в 1861 г. в статье «О химическом строении вещества». Он писал: «Исходя из мысли, что каждый химический атом, входящий в состав тела, принимает участие в образовании этого последнего и действует здесь определенным количеством принадлежащей ему химической силы (сродства), я называю химическим строением распределение действия этой силы, вследствие которого химические атомы, посредственно или непосредственно влияя друг на друга, соединяются в химическую частицу».
Сформулировав понятие химического строения, Бутлеров дает новое определение природы вещества: «Химическая натура сложной частицы определяется натурой элементарных составных частей, количеством их и химическим строением».
Следовательно, строение сложного вещества может быть установлено на основании его превращений, а химические свойства (реакционная способность) могут быть предсказаны на основании строения. Бутлеров считал, что для каждого соединения возможна лишь одна структурная формула.
Замечательным успехом теории строения явилось объяснение явления изомерии. Так, четвертый углеродный атом может быть присоединен к трехуглеродной цепи двояким способом: а) к крайнему атому и б) к среднему. Следовательно, возможен не один, а два различных порядка связи атомов в молекулах общей формулы С4Н10:
Молекулярной формулой С4Н10 могут обладать два вещества, имеющие одинаковый качественный и количественный состав, а также одинаковую молекулярную массу, но отличающиеся расположением атомов в молекулах (строением). Такие два вещества называются изомерами.
Позднее В.В.Марковников (1869) в своей диссертации «Материалы по вопросу о взаимном влиянии атомов в химических соединениях» высказал ряд положений, чрезвычайно важных для дальнейшего развития органической химии как в теоретическом, так и в практическом отношении. Одним из них явилось «правило Марковникова» о порядке присоединения галогеноводородов и хлорноватистой кислоты к несимметричным алкенам, другим - положение о большей легкости замещения атома водорода при третичном углеродном атоме по сравнению с атомами водорода у вторичного и первичного углеродных атомов и замещения атома водорода при вторичном углеродном атоме по сравнению с водородным атомом у первичного углеродного атома.
Основные положения и следствия теории строения Бутлерова могут быть кратко сформулированы следующим образом.
В молекулах соединений существует определенный порядок связи атомов, который и носит название строения.
Химические свойства соединения определяются составом и строением его молекул.
Различное строение при одном и том же составе и молекулярной массе вещества обусловливает явление изомерии.
Так как при отдельных реакциях изменяются не все, а только некоторые части молекул, то, изучая продукты химических превращений соединения, можно установить его строение.
Химический характер (т.е. реакционная способность) атомов, входящих в молекулу, меняется в зависимости от того, с какими атомами они связаны в данной молекуле. Это изменение химического характера обусловливается главным образом взаимным влиянием непосредственно связанных друг с другом атомов. Взаимное влияние атомов, не связанных непосредственно, обычно проявляется значительно слабее.
Слова Бутлерова о значении предшествовавших учений и теорий определяют дальнейшую судьбу и значение теории химического строения: «Они (прежние теории) все еще остаются пригодными в известном смысле и, отживая, входят в виде более или менее измененном как часть в состав новых теорий, более обширных. Те зависимости между фактами, которые были указаны прежними теориями, подтверждаются, расширяются и объясняются еще лучше новыми теориями, а те открытия, к которым старые теории привели, остаются прочными памятниками их заслуг».
4. Способы изображения органических молекул, пространственные модели
органический химия молекула изология
В настоящее время считается общепринятым, что одна прямая линия, соединяющая два атома, обозначает одну двухэлектронную связь (простая связь), на образование которой затрачивается по одной валентности от каждого из связанных атомов, две линии - одну четырехэлектронную связь (двойная связь), три линии - одну шестиэлектронную связь (тройная связь).
Изображение соединения с известным порядком связей между всеми атомами с помощью связей такого типа называется структурной формулой:
Для экономии времени и места чаще применяют сокращенные формулы, в которых часть связей подразумевается, но не пишется:
Иногда, особенно в карбоциклических и гетероциклических рядах, формулы еще больше упрощаются: не пишутся не только некоторые связи, но и часть атомов углерода и водорода не изображается, а лишь подразумевается (в местах пересечения линий); упрощенные формулы:
Тетраэдрическая модель атома углерода
Основные представления о химическом строении, заложенные А. М. Бутлеровым, были дополнены Вант-Гоффом и Ле-Белем (1874), которые развили идею о пространственном расположении атомов в молекуле органического вещества и поставили вопрос о пространственной конфигурации и конформации молекул. Работа Вант-Гоффа «Химия в пространстве» (1874) положила начало плодотворному направлению органической химии - стереохимии, т. е. учению о пространственном строении.
Рис. 1 - Модели по Вант-Гоффу: метана (а), этана (б), этилена (в) и ацетилена (г)
Вант-Гофф предложил тетраэдрическую модель атома углерода. Согласно этой теории, четыре валентности атома углерода в метане направлены к четырем углам тетраэдра, в центре которого находится углеродный атом, а в вершинах - атомы водорода (а). Этан, согласно Вант-Гоффу, можно представить себе как два тетраэдра, соединенных вершинами и свободно вращающихся около общей оси (6). Модель молекулы этилена представляет собой два тетраэдра, соединенных ребрами (в), а молекулы с тройной связью изображаются моделью, в которой тетраэдры соприкасаются плоскостями (г).
Такого типа модели оказались весьма удачными и для сложных молекул. Они с успехом используются и сегодня для объяснения ряда стереохимических вопросов. Теория, предложенная Вант-Гоффом, хотя и пригодная почти во всех случаях, не давала, однако, обоснованного объяснения типа и существа связывающих сил в молекулах.
5. Типы углеродного скелета
Наиболее прочной и малоизменяемой частью сложного органического вещества является его углеводородная часть и особенно углеродная цепь - углеродный скелет. В зависимости от структуры углеродного скелета все органические соединения классифицируются следующим образом.
Ациклические (алифатические) соединения
Скелет составлен из непосредственно связанных атомов углерода в виде нормальной или разветвленной цепи, в которую могут входить фрагменты с кратными связями
Карбоциклические соединения
В их молекулах углеродные цепи замкнуты в цикл, насыщенный, непредельный или ароматический
Гетероциклические соединения
В циклы молекул этих соединений кроме атомов углерода входят атомы других элементов:
6. Изомерия, гомология, изология
Одной из главных причин многообразия органических соединений является изомерия (см. главу Стереохимия). Изомерия встречается и в неорганической химии, но там она не имеет широкого распространения
HSO4 HSO3
Количество таких примеров весьма ограничено. Напротив, в органической химии явление изомерии представлено несколькими видами. А именно:
Структурная изомерия (изомерия углеродного скелета и изомерия положения)
Геометрическая
(этот вид изомерии можно наблюдать в дизамещенных циклоалканах, когда заместители стоят по одну или по разные стороны кольца)
Пространственная (стерео-), которую часто называют оптической, т.к. она связана с оптической активностью пространственных изомеров
Стереоизомерами называются изомеры, имеющие одинаковую последовательность химических связей атомов, но различное расположение этих атомов относительно друг друга в пространстве.
Динамическая изомерия (таутомерия) встречается в различных классах соединений; наиболее известна кето-енольная таутомерия
Таутомерия - явление равновесной динамической изомерии, при которой происходит быстрое обратимое самопроизвольное превращение структурных изомеров, сопровождаемое миграцией подвижной группы между двумя или несколькими центрами в молекуле.
Явление изологии - это существование соединений с одинаковой длиной углеродной цепи, но отличающихся друг от друга характером углерод-углеродной связи (ординарная, кратная)
Более всего распространено в органической химии явление гомологии. Гомологический ряд - это бесконечный ряд веществ, каждый последующий член которого отличается от предыдущего на группу СН2, называемую гомологической разностью. Все члены гомологического ряда обладают сходными химическими свойствами вследствие сходства их химического строения. Каждый последующий член такого ряда (гомолог) может быть выведен из предыдущего путем замещения на метильную группу атома водорода, связанного с атомом углерода углеродного скелета, или путем внедрения группы СН2 между двумя углеродными атомами скелета.
7. Классы органических соединений
В каждом из типов углеродного скелета все соединения распределяются по классам в зависимости от входящих в их состав функциональных групп.
Функциональной группой называют атом или группу атомов, определяющих принадлежность соединения к конкретному классу и ответственных за его химические свойства.
Например, класс ациклических спиртов (группа -ОН), класс ациклических аминов (группа -NH2), класс карбоциклических карбоновых кислот (группа -СООН), класс металлоорганических соединений и т. д.:
Кратную связь также можно рассматривать как функцию. Соответственно углеводороды, содержащие кратные связи, подразделяются на алкены, алкины, диены и т. д.
Соединения с несколькими одинаковыми функциональными группами называются полифункциональными
Если в молекуле содержатся разные функциональные группы, то соединение относят к классу гетерофункциональных
8. Основы номенклатуры в органической химии
На первых этапах развития химии вновь открытым соединениям присваивались, как правило, тривиальные названия, чаще связанные с источником получения, чем со структурой. Такие названия прочно укоренились и до сих пор являются общепринятыми: муравьиная кислота, уксусный альдегид, ацетон, хлороформ и т. д. В химии природных соединений это часто практикуется и в наши дни. Однако количество новых соединений росло очень быстро, и возникла необходимость связывать названия со строением вещества. В связи с этим появились рациональные названия: метилэтилкетон, диметиламин, триметилуксусная кислота, триметилкарбинол и т.п. В этих случаях, как правило, соединение рассматривают как замещенное теми или иными радикалами простейшее соединение данного ряда.
Однако для более сложных систем рациональная номенклатура была непригодна, и потребовалось создание научной номенклатуры, в которой название соединения и его структура Должны были однозначно соответствовать друг другу. Международный союз чистой и прикладной химии (International Union of Pure and Applied Chemistry - IUPAC) разработал и предложил (1957, 1965) в качестве официальной научной номенклатуры номенклатуру ИЮПАК.
В основу названия соединения по этой номенклатуре положена углеродная цепь молекулы, содержащая максимальное число функциональных групп (гидроксил, карбоксил, аминогруппа и т. д.). Начало нумерации цепи определяет наиболее старшая функциональная группа, или, если таковой нет (например, в молекулах алканов), цепь нумеруют таким образом, чтобы сумма номеров атомов, при которых стоят заместители, была наименьшей. Порядок старшинства основных функций следующий:
СООН > SO3H > CN > СНО > СО > ОН > NH2 > NO2 > Hal
Главная функция обозначается в названии суффиксом: гидроксильная группа -ол; альдегидная -аль; кетонная -он и т. д., остальные - префиксами. Например:
Общая схема построения названия имеет вид:
префиксыкореньсуффиксы указывают:указывают русские названия всех функциональных групп в алфавитном порядке (кроме старшей группы)указывает название главной углеродной цепи или карбоциклической или гетероциклической структурыстепень насыщенности главной углеродной цепи (-ан, -ен, ин)название старшей группы
Основные функциональные группы, обозначаемые суффиксами и префиксами, в порядке убывания их старшинства
Класс соединений и общая формулаФункциональная группаПрефиксСуффиксКарбоновые к-ты R-COOHКарбоксил -COOHкарбокси--(карб)оновая к-таСульфоновые к-ты R-SO3HСульфокислотная -SO3Hсульфо-сульфоновая к-таСложные эфиры R-COOR"Алкилкарбоксилатная -COOR"карбоалкокси-алкил…оатАмиды R-COONH2Амидная -COONH2карбамоил--амиднитрилы (цианиды) R-CNнитрильная -CNциано--нитрилАльдегиды RАльдегидная -CHOоксо--альКетоны R-CO-R"карбонильная -CO-оксо--онСпирты R-OHГидроксильная -OH(гидр)окси--олТиолы R-SHМеркаптогруппа -SHмеркапто--тиолАмины R-NR2аминогруппа -NR2амино--аминАлкины CnH2n-2 -инАлкены CnH2n -енАлканы CnH2n+2 -ан
Функциональные группы, обозначаемые только префиксами
Класс соединений и общая формулаФункциональная группаПрефиксГалогенпроизводные R-Hal-F; -Cl; -Br; -Jгалоген(о)-Нитропроизводные R-NO2-NO2нитро-Простые эфиры R-O-R"-ORалкокси-Сульфиды R-S-R"-SRалкилтио-Дисульфиды R-S-S-R"-S-SRалкилдитио-Гидропероксиды R-O-OH-O-OHгидроперокси-Алкилпероксиды R-O-O-R"-O-ORалкилперокси-
Литература
1. Артеменко А.И., Тикунова И.В., Ануфриев Е.К. Практикум по органической химии. - М.: Высшая школа, 2001-187 с.
Березин Б.Д., Березин Д.Б. Курс современной органической химии. Учебное пособие для вузов. - М.: Высшая школа, 2001. - 768 с.
Глинка Н.Л. Общая химия / Под ред. В.А. Рабиновича.- Л.: Химия, 2006. - 704 с.
Градберг И.И. Практические работы и семинарские занятия по органической химии. - М.: Дрофа, 2001. - 352 с.
Заказ работы
Наши специалисты помогут написать работу с обязательной проверкой на уникальность в системе «Антиплагиат»
Отправь заявку
с требованиями прямо сейчас, чтобы узнать стоимость и возможность написания.
